top of page

Licenciatura en Química
Yuliza Chavez - Katherin Rivera

ENLACES QUÍMICOS
Solo los gases nobles se presentan en la naturaleza como átomos separados. En la mayoría de los materiales, los átomos están unidos con enlaces químicos. Los enlaces químicos son las fuerzas que mantienen unidos a los átomos en las moléculas de los elementos, como O2 y Cl2; de compuestos como CO2 y H2O y de metales. Un enlace químico se forma entre dos átomos, si la disposición resultante de los dos núcleos y sus electrones tienen una energía menor que la energía total de los dos átomos separados.
Se clasifican en:
-
ENLACE IÓNICO: Es la atracción que existe entre iones de carga opuesta. Es la transferencia de electrónes. Se da entre metales y no metales.
IÓN: un átomo cargado positiva o negativamente, el número de protones no es igual al de electrones.
Interviene la electronegatividad, para que se puedan transferir los electrones. Los elementos del grupo IA y IIA forman enlaces iónicos con los elementos del grupo VIIA y con el oxígeno. Se representa con ayuda de las estructuras de Lewis.

Propiedades:
* Forman estructuras cristalinas.
* Son sólidos a temperatura ambiente.
* No conducen electricidad en estado sólido, pero si en solución acuosa.
* Los cationes son atraídos por el cátodo (carga negativa) y los aniones por el ánodo (carga positiva).
* Punto de fusión y punto de ebullición muy altos.
* Se disuelven en agua.

Tomado de: https://1.bp.blogspot.com/-yTaDEaW0f1s/VUT3BIPUpLI/AAAAAAAAMkQ/IP-g29ZbJkw/s1600/zqwywy.jpg
-
ENLACE COVALENTE: Los átomos al unirse comparten electrones, al compartir los electrones de valencia completan la configuración de gas noble, se da entre elementos no metálicos, es común entre elementos como el O, Cl y F. Pueden compartir 1,2 o 3 electrones de valencia, se forman moléculas y no estructuras cristalinas.
Tipos de enlace covalente:
* Covalente no polar: Tienen las mismas electronegatividades, no se generan cargas parciales.


* Covalente polar: Tienen diferentes electronegatividades. Se forman cargas parciales positivas y negativas. Forman dipolos.
* Covalente coordinado: Uno de los átomos cede los dos electrones y el otro solo ofrece el espacio para acomodarlos.
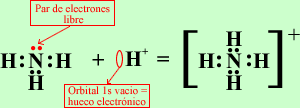
Propiedades:
* Se presentan en los tres estados de agregación.
* Forman moléculas.
* Bajo punto de ebullición y punto de fusión.
* Pueden disolverse en sustancias polares y no polares dependiendo de su origen.

-
ENLACE METÁLICO: Se encuentra en los grupos IA, IIA y metales de transición, posee un ordenamiento cristalino rígido, puede ser cubico, hexagonal, etc. Es una red de núcleos cargados positivamente en un mar de electrones, se genera por la atracción entre los electrones móviles y los iones positivos del metal.
Características:
* Brillo y lustre metálico.
* Sólidos a temperatura ambiente excepto el mercurio.
* Alto punto de fusión y punto de ebullición.
* Dúctiles: Pueden formar hilos o alambres.
* Maleables: Pueden hacerse láminas.
* Reaccionan con el oxigeno para formar óxidos básicos..
* Pierden electrones cuando reaccionan químicamente. formando cationes.
-
INTERACCIONES MOLECULARES; ENLACE POR PUENTE DE HIDROGENO: Son fuerzas de atracción entre moléculas que poseen dentro de su estructura hidrógeno y un átomo muy electronegativo. (Agua (H2O), amoniaco (NH3) fluoruro de hidrógeno (HF)). Se trata de la interacción de un átomo de hidrogeno y la región electronegativa de otras moléculas en las que existen elementos muy electronegativos que no compartan electrones.
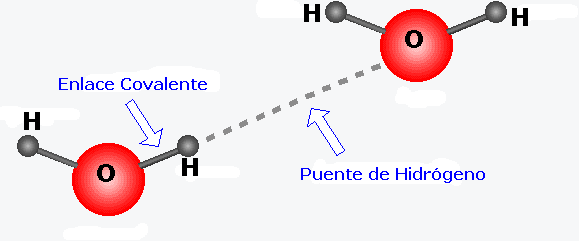
bottom of page